详细信息
同位素与气体浓度分析仪 所测气体 二氧化碳 甲烷 | Picarro G2131-i
文章的作者是Proteinaceous公司的Matthew T. Robey和Kenneth Durbin。自上而下质谱法 (TDMS) 已成为表征完整蛋白质和抗体的强大工具。与普遍的使用的肽图分析方法相比,TDMS 允许精确测定和定量样品中存在的特定蛋白质形式(即序列和修饰变体)。尽管有这些优势,但 TDMS 碎裂谱图可能要复杂得多,这使得数据解释具有挑战性。解释 TDMS 谱图通常涉及质量去卷积,它将包含多种同位素和电荷态的谱图重新计算为中性碎片质量,以便与潜在的蛋白质形式作比较。目前大部分的软件采用的去卷积方式是先进行质谱峰的分子量计算,再将理论分子量与计算值匹配。但是去卷积时可能没办法检测到低丰度的片段,或者其同位素被复杂谱图中的重叠信号掩盖。另一种策略是直接将候选蛋白质形式的理论离子与碎裂谱作比较,避免了非靶向去卷积方法的缺陷(图1)。作者推出了一种基于同位素拟合的谱图匹配软件,它使用候选蛋白质形式创建理论片段同位素分布,然后使用最小二乘回归模型将其与实验分布作比较,并应用于完整质量的单克隆抗体的工作流程。根据结果得出同位素拟合可以使序列覆盖率增加三倍,并且同位素拟合能大大的提升对跨越内部重链区域的大片段的检测。
图 1.用于谱图匹配的常规去卷积与同位素拟合方法的比较。(A) 在去卷积方法中,原始谱图在与候选蛋白质形式匹配之前被转换为中性片段质量。(B) 在同位素拟合方法中,将候选蛋白质形式的理论同位素分布直接与没有去卷积的实验谱图进行比较。
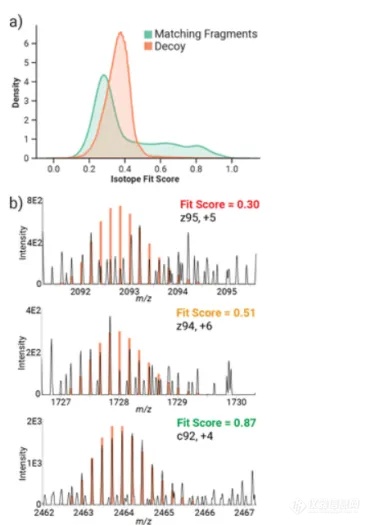
为了对同位素拟合进行基准测试,作者在 128 个碎裂设置中处理了来自完整 NIST单克隆抗体数据集的 27,000 张碎裂谱图。每个谱图都使用同位素拟合和现有的 ProSight Lite去卷积办法来进行处理。为了估计同位素拟合的初始错误发现率 (FDR),作者检查了具有最多匹配片段的数据文件 (AI-ETD),使用 100 个随机加扰的轻链和重链序列的诱饵分布,观察到在较高的同位素拟合分数下,真实匹配片段的比例高于诱饵匹配片段
。为了估计同位素拟合的错误发现率 (FDR),作者还考虑了谱图匹配水平的诱饵与实际分布。在这项分析中,我们对单个碎片离子使用了 0.5 的拟合分数阈值,并计算了每个谱图匹配中结果匹配碎片的平均拟合分数。对于此分析,谱图匹配的平均拟合分数为 0.68,对应于 5% 的 FDR。
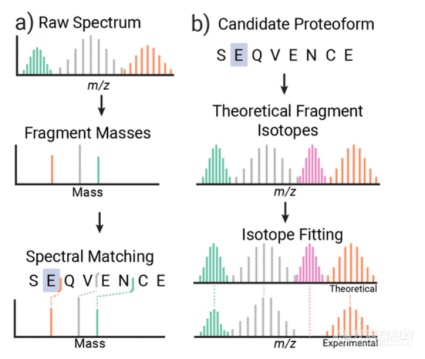
图 2.在没有去卷积的情况下对蛋白质形式谱图匹配的同位素拟合分数进行基准测试。(a) 碎片谱图的匹配片段分布与诱饵分布。(b) 不同拟合分数的匹配碎片离子示例。作者还研究了内部离子,以确定它们的普遍性并评估它们对更高 FDR 值的潜在贡献。使用 ProSight Native 中的 TDValidator 模块,作者发现 52% 和 19% 的匹配碎片分别是顶部 HCD 和 ETD 谱图匹配中的内部离子。
作者使用热图来可视化同位素拟合与去卷积的序列覆盖率。每行代表 128 种不同碎裂设置中的最佳谱图匹配,每列表示序列中的一个氨基酸(图 3a 和 3b)。作者观察到同位素拟合与去卷积的明显差异,由于序列覆盖率的增加,两条链的几个区域颜色更浓。在这些匹配中,使用质量去卷积的序列覆盖率分别仅为 13 ± 5% 和 13 ± 4%。而使用同位素拟合时重链覆盖率增加了 3 倍,达到 39%(图 3d),轻链序列覆盖率增加了 2.5 倍,其中轻重链可变区的序列覆盖分别从21 ± 9% 和 23 ± 8%提高到 42 ± 21% 和 39 ± 17%。将 THRASH 质量去卷积的可靠性值质量评分从 0.55 降低到允许的最小阈值 0.01 导致每个谱图检测到的片段质量数增加约 30%,但仅略微增加了序列覆盖率约 1%。这表明较低的可靠性值阈值会大幅度提升假阳性片段质量数的数量,而不会明显地增加序列覆盖率。
图 3.比较 27 000 个碎裂谱图和 4 种碎裂类型的 (a) 去卷积与 (b) 同位素拟合谱图匹配。
对于完整的抗体链,检测大片段对于获得整个蛋白质的序列覆盖至关重要。然而,由于多个电荷会降低强度,因此大碎片可能难以去卷积。使用同位素拟合,我们观察到大匹配片段的数量增加。在上述 128 个最佳谱图匹配中,使用质量去卷积的匹配碎片质量为 6,917 ± 5016 Da,而使用同位素拟合的匹配碎片的质量为 8,478 ± 4688 Da。

总的来说,作者提出了一种替代去卷积的谱图匹配方法,该方法放弃了典型的质量去卷积步骤,而是通过理论同位素分布直接将候选蛋白质形式与谱图作比较。根据结果得出,同位素拟合可以在不增加 FDR 的情况下显着增加大蛋白(如抗体)的序列覆盖率。此外,通过利用批处理模式下的方法对较大的TDMS的数据集进行高通量分析,同位素拟合可用于多个谱图分析。蛋白质片段数据分析的这些改进和未来改进将有利于更好地确定 TDMS 在定义生物治疗药物的蛋白质形态方面的作用。


